Бактеріофаги повернулися до боротьби людей із бактеріями, паралізованим травмою спинного мозку мишам повернули здатність ходити, а для допомоги в діагностуванні депресії розробили точний аналіз крові. Ці та інші важливі новини медичної науки — у нашому січневому дайджесті.
CRISPR проти старіння дітей
Прогерія є дуже несправедливим захворюванням: всі люди неминуче старіють, але хворі цією недугою роблять це в кілька разів швидше, ніж мали б. Якщо мова йде про дитячу прогерію, або синдром Гетчінсона-Гілфорда, то діти починають старіти ледь не одразу з народження. На жаль, середня тривалість життя таких пацієнтів складає близько 13-14 років. Синдром Гетчінсона-Гілфорда спричиняється мутацією всього єдиної букви з понад 3 мільярдів пар у людському геномі. Дефект припадає на одну з двох копій гену, що кодує білок ламін А. Внаслідок мутації організм виробляє неправильний варіант цього білка, що має назву прогерин. Він перешкоджає нормальному поділу клітин та призводить до ранньої появи симптомів старіння.
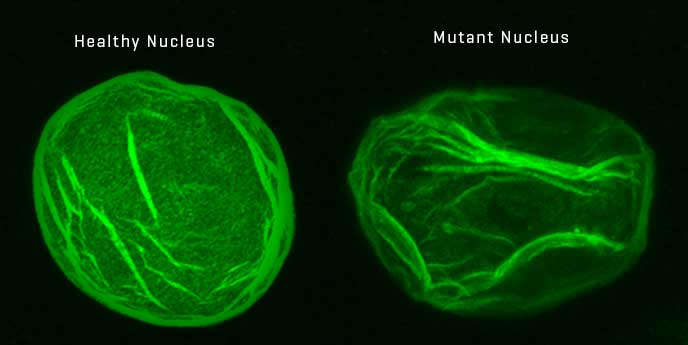
Ядро клітини здорової людини (зліва) та хворої на прогерію (справа). Dr. Susan Parkhurst / Current Biology, 2015
Наразі не існує методів, що дозволяли б вилікуватися від дитячої прогерії, але їх розроблення активно ведеться. Позаяк це генетична хвороба, то вчені покладають надії на генну терапію. Утім, звичайні методи редагування геному, коли в ДНК додається робочий варіант гену, у цьому випадку не допоможуть: пацієнти з прогерією вже мають одну правильну версію гену, а проблема полягає саме в наявності дефектної копії. Більш сучасний метод CRISPR може розрізати ДНК у потрібному місці, але є ризик пошкодити й здорову версію гену. Та вченим з Гарвардського університету вдалося модифікувати технологію у такий спосіб, щоб вона розрізала не обидві нитки ДНК, а лише одну з них, і при цьому замінювала дефектну основу на нову.
Новий підхід науковці протестували на лабораторних мишах з дитячою прогерією. Під час лікування тваринам було всього два тижні, що еквівалентно приблизно п’яти рокам у людей. Через пів року після ін’єкції вірусів, що несуть інструмент редагування геному, до 60 відсотків клітин у хворих мишей містили правильний варіант раніше дефектного гена. Це було помітно і по суттєво більш жвавим мишам. Але найголовніше — вони прожили вдвічі довше, ніж неліковані піддослідні миші.
Вчені дуже сподіваються, що успішні результати призведуть до розроблення нового методу терапії прогерії людей. Але наскільки це ймовірно стане зрозуміло лише з наступних дослідів.
Сплячка ракових клітин
Сплячка — це пристосування тварин, яке дає їм змогу пережити несприятливі періоди. У цей час їхній метаболізм сповільнюється, знижується температура тіла, самі вони при цьому не харчуються, а енергію економно беруть із запасів поживних речовин організму. Щось схоже може відбуватися і з зародками, для повноцінного розвитку яких умови залишаються несприятливими, приміром, матері не вистачає їжі. У такому разі процес називається ембріональною діапаузою, і в цей час ембріон тимчасово припиняє свій розвиток.
Канадські дослідники, вивчаючи рак, помітили, що деякі злоякісні пухлини мають ознаки ембріональної діапаузи теж. Вже певний час відомо, що навіть після успішного досягнення ремісії раку, в організмі пацієнтів можуть залишатися сплячі ракові клітини, що ніяк себе не проявляють. Але завжди є ризик, що вони активуються знову та дадуть початок розвитку нових пухлин.
Вчені провели серію експериментів на культурі злоякісних клітин, яких обробляли протираковими препаратами, та піддослідних мишей з раком, які проходили хімієтерапію. Так вони з’ясували, що в сплячку ракові клітини впадають за присутності хімієтерапевтичного препарату, що можна розглядати з їхньої точки зору як несприятливі умови. У цей час вони перестають поділятися та запускають процес автофагії — поїдання власних білків та інших поживних речовин замість отримання їх зовні, щоб пережити несприятливі умови. Тож клітини втрачають чутливість до протиракового засобу, але після його скасування можуть “прокинутися” та відновити активність. Цей механізм дуже схожий на той, що властивий ембріональним клітинам при діапаузі, зокрема, на рівні експресії генів.
Можливо, це ключ до розроблення нового лікування раку: якщо перешкодити або пригнітити автофагію злоякісних клітин, є надія, що вони не зможуть запустити захисний механізм та залишаться чутливими до хімієтерапії.
Ракові клітини в спадок
У людей не виявлено окремого типу заразного раку, хоча у тваринному світі такі злоякісні хвороби не є рідкісними. Та все ж описано кілька випадків, коли люди заражалися раковими клітинами від інших осіб. Зазвичай інфікованими були люди із сильно ослабленою імунною системою: пацієнти після трансплантації органів або хворі на СНІД. Інколи рак може передаватися від матері до дитини, ймовірно, під час внутрішньоутробного розвитку плода. Але японські дослідники описали ще унікальніший випадок — двоє жінок передали свої ракові клітини дітям під час пологів.
Обидві матері хворіли на рак шийки матки, однак дізналися про це лише після народження дітей. У їхніх синів у віці кількох років почалися скарги на кашель та біль у грудях, які виявилися симптомами раку легень. Найдивнішим у цій історії була відсутність у ракових клітин хлопчиків Y-хромосоми, яка присутня майже в усіх клітинах чоловічої статі. Глибше вивчення цих клітин показало, що вони також мають мутації, схожі на такі у ракових клітинах шийки матки матерів. При цьому в пухлинах дітей виявили сліди папіломавірусів, які є одними з головних чинників раку шийки матки.
Науковці припускають, що інфікування відбулося безпосередню під час пологів: хлопчики могли вдихнути ракові клітини шийки матки під час проходження через родові шляхи матері. Це може пояснити, чому у дітей розвинувся саме рак дихальної системи. Тож автори наукової роботи рекомендують вагітним із раком шийки матки віддати перевагу кесаревому розтину, щоб зменшити ризик передачі хвороби своїм дітям.
Повернення бактеріофагів проти супербактерій
Інфекції, спричинені бактеріями, все ще є одними з головних загроз для здоров’я людей та тварин. Зараз найкращою нашою зброєю проти бактеріальних збудників є антибіотики, але це не триватиме довго. Бактерії дуже стрімко набувають стійкості до антибактеріальних препаратів, залишаючи нас вразливими перед інфекціями, як в часи Темного Середньовіччя. Але мало хто знає, що ще до відкриття пеніциліну Александером Флемінгом науковці розглядали інший варіант лікування бактеріальних інфекцій, який після винайдення антибіотиків втратив актуальність. Але саме до нього тепер повертаються вчені, нажахані темпами поширення антибіотикорезистентності. Звісно, мова йде про бактеріофагів — вірусів бактерій.
Австралійські дослідники вирішили не обіймати одразу великі обсяги роботи, тож зосередилися для початку на пошуку бактеріофагів, які допомогли б боротися з бактерією Acinetobacter baumannii. Це збудник, який часто можна зустріти в лікарняних умовах, отже він може швидко мутувати та набувати стійкості до широкого спектра протимікробних засобів. Врешті вчені знайшли підхожий вірус у стічних водах.
Всупереч очікуванням, такий розшукуваний бактеріофаг не зміг побороти витривалу A. baumannii. Але він приніс користь інакше. З’ясувалося, що після оброблення стійких до майже всіх антибіотиків колоній A. baumannii бактеріофагами, збудники знову набували чутливості до препаратів. Тобто антибактеріальні засоби знову стали вбивати бактерій. Схоже, у нас є шанс не програти.
Гриби у венах
У першій половині січня соціальні мережі сколихнула новина про американського пацієнта. Вона стосувалася 30 річного чоловіка, який спробував лікуватися від депресії та опіоїдної залежності внутрішньовенною ін’єкцією відвару псилоцибінових грибів. Про незвичайний клінічний випадок написали вчені Медичної школи Крейтонського університету.
Молодий чоловік прочитав, що мікродози ЛСД та псилоцибіну можуть мати терапевтичний ефект, тож вирішив вдатися до самолікування. Він зробив собі внутрішньовенну ін’єкцію розчину, названого ним “грибним чаєм”. По суті чоловік залив гриби окропом, процідив їх через бавовняний тампон та ввів розчин у вену. Через кілька днів у нього проявилася летаргія, жовтяниця, діарея, нудота та блювання кров’ю, що стало причиною госпіталізації. Лікарі діагностували у пацієнта серйозне множинне враження внутрішніх органів. Аналізи показали, що у хворого відбулося інфікування крові бактеріями, але що дивніше — у крові також проросли гриби Psilocybe cubensis. Ті самі, “чай” з якого чоловік увів у вену. Пацієнта врятували — протягом 22 днів його лікували антибіотиками та протигрибковими препаратами в лікарні, а крім цього виписали довготривале лікування протимікробними засобами після виписки.
Деякі базидіомікотові гриби, що живуть у вигляді дріжджів або дріжджоподібних грибів, не раз ставали причиною грибної інфекції крові. Хоча це перший задокументований випадок розмноження у крові людини грибів порядку Агарикальні, які утворюють плодові тіла. Між тим, науці відомі випадки коли агарикальні гриби зростали у внутрішніх органах людей. Приміром, гіфи розщепки звичайної (Schizophyllum commune), що зазвичай росте на деревині, знаходили в легенях та навіть мозку пацієнтів, а Tropicoporus tropicalis — у кістках та кістковому мозку. Гриб гнойовик Coprinopsis cinerea викликав запалення внутрішньої оболонки серця. Та навіть їстівні гриби іноді можуть обжитися в людських тілах: наприклад, солом’яний гриб (Volvariella volvacea) проріс у мозкові хворої на рак пацієнтки.
Встали й пішли
Травми хребта — це одні з найважчих для лікування. На жаль, після пошкодження спинного мозку внаслідок такого ураження людина часто втрачає можливість вільно рухатися. Інколи в неї паралізуються ноги, або навіть і руки. Причина цього у тому, що розірвані аксони спинного мозку самостійно вже не можуть зростися належним чином. Але чимало наукових лабораторій працюють над створенням засобів, які могли б допомагати нервовій системі відновитися.
Дослідники з Рурського університету звернули увагу на білок інтерлейкін-6, але не на природну його форму, а на штучно модифіковану, яка називається гіпер-інтерлейкіном-6 (hIL-6). Раніше науковці вже виявляли у цього білка потенціал до стимуляції нервової регенерації. Але німецькі вчені припустили, що найкращого ефекту можна досягти, якщо змусити організм самостійно виробляти hIL-6. Щоб це зробити, вони звернулися до методів генної терапії. За допомогою аденоасоційованих вірусів дослідники ввели в геном піддослідних мишей з паралізованими кінцівками інструкції з вироблення неприродної версії інтерлейкіну-6.
Результати експерименту виявилися по-справжньому дивовижними. У піддослідних мишей після ін’єкції з вірусами почалася регенерація критично пошкодженого спинного мозку. А через кілька тижнів після втручання тварини знову почали ходити. Такого успіху у відновленні рухової активності після паралічу ще не досягали. Цього разу терапію починали безпосередньо після пошкодження спинного мозку мишей, а надалі автори спробують повторити успіх при лікуванні більш давніх травм.
Майже алергія в животі
Діарея, дискомфорт і біль у животі після приймання певних харчових продуктів є одним із симптомів синдрому подразненого кишківника (СПК). Від цієї недуги страждає від 15 до 45 відсотків населення нашої планети. Особливістю стану є те, що здебільшого лікарям не вдається виявити якісь органічні причини симптоматики хворих: обстеження та аналізи показують, що пацієнт здоровий. Тому часто синдром подразненого кишківника пояснюють надмірною тривожністю та іпохондрією. Але вчені поспішають на допомогу пацієнтам, щоб допомогти розібратися із примарною хворобою.
Нещодавно група з понад 40 науковців зайнялася вивченням гіпотези, згідно з якою біль у животі після приймання їжі проявляється через алергічну реакцію. Піддослідних мишей заразили збудниками кишкової інфекції, оскільки відомо, що останні можуть провокувати виникнення СПК. Під час хвороби частині лабораторних тварин згодовували яєчний білок. А після одужання мишей їм всім знову стали додавати яєчний білок до раціону.
З’ясувалося, що у тварин, які під час хвороби теж їли білок яйця, після одужання спостерігалася незвичайна реакція кишківника на цей продукт. Імунні тучні клітини кишечника ставали надмірно активними. Ймовірно, під час хвороби зайнята боротьбою з патогенами імунна система сприймає деякі звичайні білки їжі за антиген, як частини бактерій. Через це в організмі починають вироблятися антитіла проти цих білків, а коли ці дві зв’язані молекули приєднуються до тучних клітин, останні вивільняють такі хімічні сполуки як гістамін, що здатні збуджувати нейрони поблизу. Саме ця надмірна активація нервових клітин молекулами тучних клітин сприймається нами як біль у животі.
Потім дослідники провели досліди на людях із СПК. Після того, як їм ректально ввели антигени їжі, наприклад, сої, глютену, молока чи пшениці, їхні тучні клітини активувалися так само. Тож вчені вважають, що за болем у животі часто може стояти неадекватна імунна реакція. Як алергічна, але зосереджена локально в кишківнику. Звідси напрошується припущення, що лікувати СПК та схожий біль у животі можна за допомогою антигістамінних засобів. Але це ще слід перевірити в подальших дослідах.
Аналіз крові на депресію та біполярний розлад
Депресія та біполярний розлад характеризуються порушеннями настрою. Якщо перша хвороба проявляється пригніченим та меланхолічним настроєм, то для другої властиві періодичні прояви як депресивних симптомів, так і їхньої протилежності — маніакальних. Діагностування цих станів зараз відбувається головно на основі застосування суб’єктивних методів, як-от опитувань, тестів та співбесіди. Проте науковці з Університету Південної Австралії та Медичного університету Кунміна зайнялися розробленням першого об’єктивного методу діагностики психічних розладів.
У своєму дослідженні вчені сфокусувалися на білку BDNF. Це фактор росту клітин, який сприяє утворенню нових нейронів у головному мозку. Однак він існує у трьох формах — зрілого BDNF, попередника BDNF та продомена BDNF. Дві останні варіації, на відміну від зрілої, пов’язують із нейродегенерацією та запаленням. Водночас низькі рівні зрілого BDNF мають зв’язок із депресією та іншими патологічними розладами настрою. Науковці з Австралії та Китаю розробили перший метод якісно відрізнити ці три типи білків.
Після цього дослідники залучили до дослідів добровольців, частина з яких страждала на депресію, біполярний розлад чи суїцидальні схильності. За аналізами їхньої крові з’ясували, що у пацієнтів із депресією та біполярним розладом дійсно занизькі рівні зрілого BDNF. Хоча приймання антидепресантів дещо підвищує його концентрацію. Однак що стосується людей, які вчиняли спроби самогубства, то в їхній крові кількість зрілого BDNF була такою ж, як і в здорових людей. Ймовірно, за цим станом стоять причини, які ми поки що не зовсім розуміємо, припускають вчені.
Базуючись на результатах, автори наукової роботи розробили тест для діагностування депресії та біполярного розладу. На їхню думку, рівень зрілого BDNF у крові пацієнта нижче 12,4 нанограма на мілілітр можна вважати підозрою на згадані психічні розлади. Точність методу діагностики складає 80-83 відсотки, за словами вчених.
Зворотний хід деменції
Атеросклероз, метаболічний синдром, рак, зниження когнітивних здібностей, деменція. Ризик розвитку цих станів суттєво зростає у процесі старіння. Їх поєднує спільний чинник виникнення — тривалі запальні процеси в організмі, спричинені дисфункцією імунної системи. Якщо знайти спосіб зменшити або усунути прояви запалення, то, можливо, можна сповільнити або уникнути вікові зміни, зокрема, зниження інтелекту. Але перш ніж спробувати зробити це, необхідно зрозуміти, які механізми взагалі призводять до виникнення та підтримання запалення в організмі літніх людей. Вивченням цього питання зайнялися науковці зі Стенфордського університету в недавній роботі.
Вчені сфокусувалися на гормоні простагландині Е2 (PGE2), однією з функцій якого є ініціювання запалення. Вибір пав на вивчення цієї сполуки, оскільки відомо, що з віком її рівні в крові зростають. У перших дослідах автори порівняли імунні клітини макрофаги людей старше 65 років та молодших 35, а також макрофаги старих і молодих мишей. Так вони з’ясували, що PGE2 безпосередньо запускає запальні механізми у макрофагах. У старшому віці клітини починають виробляти більше PGE2, а на додачу макрофаги ще й мають більше рецепторів Е2 на своїй поверхні, з якими простагландин зв’язується.
Тож далі науковці спробували заблокувати механізм зв’язування PGE2-EP2. Досліди на культурі старих макрофагів показали, що таке втручання призводить до їхнього омолодження через відновлення нормального клітинного метаболізму. Тож далі досліди провели на пристарілих лабораторних мишах. Гальмування зв’язування PGE2-EP2 призвело до цікавого ефекту у тварин. У мишей не те що зупинилося подальше вікове зниження когнітивних здібностей, а взагалі інтелект повернувся до такого рівня, що в молодості. Це підтвердилося результатами проходження тестів, які порівнювали з успіхами молодих мишей.
Так американські вчені показали, що вікове зниження когнітивних здібностей, а може й деменцію, можна відвернути. Щонайменше, у мишей. Поки що науковці не знають, чи безпечним було би таке втручання в людський організм.