Американські та сингапурські вчені описали технологію віддаленої глибокої мозкової стимуляції у тварин за допомогою світла в діапазоні ближнього інфрачервоного випромінювання та наночастинок. Вона подібна до оптогенетики, але активація нейронів здійснюється не безпосередньо світлом, а теплом, що його генерують попередньо введені у мозок наночастинки, під дією світла. Так науковці змогли змінити поведінку мишей, освітлюючи арену з тваринами з відстані понад 50 сантиметрів, без використання імплантатів, властивих оптогенетиці. Дослідження опубліковане в журналі Nature Biomedical Engineering.
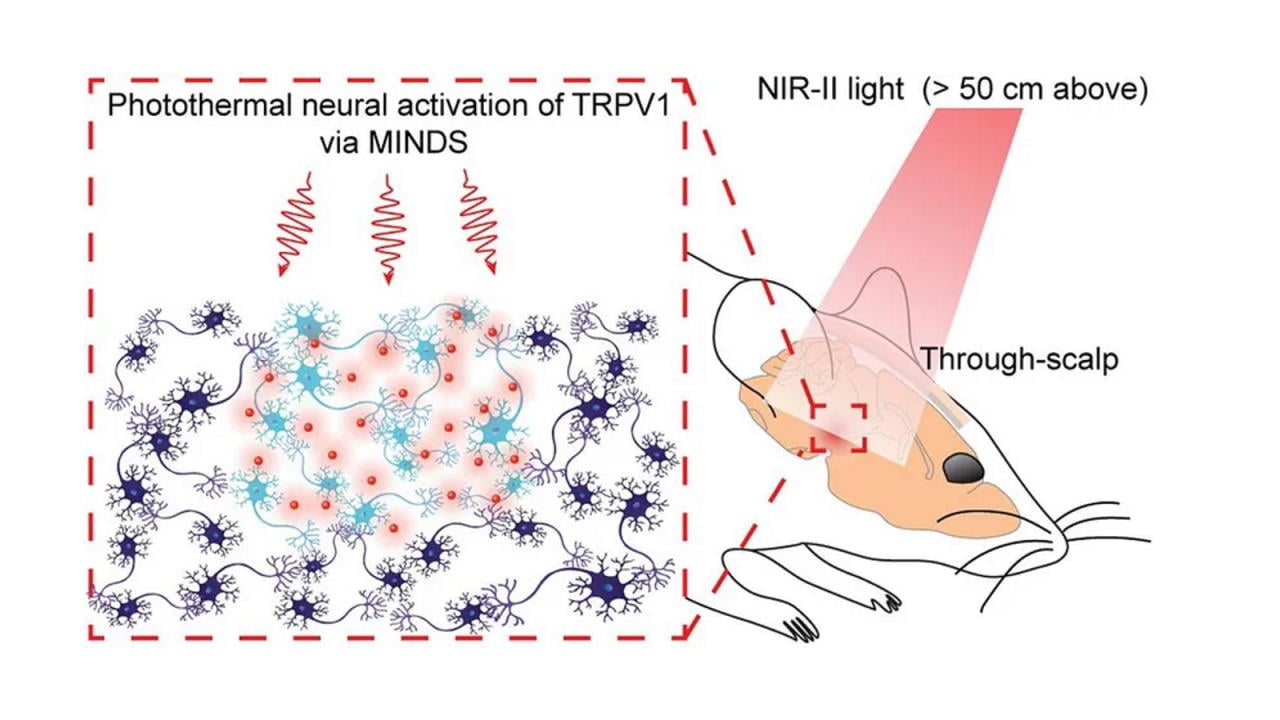
Схематичне зображення роботи запропонованої системи з наночастинками, білком TRPV1 та світлом у ближній інфрачервоній області, яке подається з висоти понад 50 сантиметрів і проникає через скальп та череп тварини. Xiang Wu et al. / Nature Biomedical Engineering, 2022
Що таке оптогенетика і в чому її недоліки?
Оптогенетика дає змогу контролювати роботу нейронів мозку, впливаючи на них світлом. Для цього нейрони попередньо генетично модифікують для надання їм здатності реагувати на світло, доставляючи в них ген світлочутливого білка. Оптогенетика — корисний підхід, коли необхідно зрозуміти, які функції виконують ті чи інші групи нервових клітин, і багато нових знань про роботу мозку отримано саме завдяки йому. Утім, наразі технологія активно розвивається і все ще має свої недоліки. Так, важливою вимогою для керування мозковою активністю є доставлення світла певної довжини в черепну коробку на достатню для стимуляції глибину. Зазвичай для цього використовують мозкові імплантати, від яких відходять довгі оптичні волокна. І це працює, але сильно обмежує рухливість тварини, тому не дає їй змогу поводитися природно, а вченим — вивчати роботу мозку під час звичайної поведінки тварин, зокрема соціальної. Також із часом імплантат травмує мозкову тканину, що перешкоджає нормальній його роботі.
Через це зростає попит та увага до неінвазивних інструментів керування нейронами. Розробку в цій галузі представили й науковці Стенфордського університету та Наньянського технологічного університету.
Як вони пропонують контролювати мозок?
Науковці вирішили використати не видиме світло, а ближнє інфрачервоне випромінювання в діапазоні 1 000-1 700 нанометрів, точніше — 1 064 нанометри. Хвилі такої довжини відносно легко проникають через тканини живих організмів, зокрема крізь скальп і череп, тому потенційно можуть використатися для неінвазивної глибокої стимуляції мозку.
Однак цього разу нейрони реагували не на саме світло, а на тепло. І замість внесення у клітини генів опсинів (світлочутливі білки, що їх використовують в оптогенетиці), використовували білок, що природно виконує функцію терморецептора — TRPV1. Щоб активувати його, вчені розробили біосумісні полімерні наночастинки розміром близько 40 нанометрів, розчин яких вводиться у ділянку мозку, яку мають намір проконтролювати. Частинки успішно поглинають ближнє інфрачервоне випромінювання з хвилями довжиною 1 064 нанометри й перетворюють його на тепло, яке активуватиме рецептор TRPV1. Попередні досліди показали, що ефективність фототермічного перетворення наночастинками сягає 71 відсотка, і вони нагріваються до 39 градусів Цельсія усього за 1,1 секунди.
Таким чином, технологія перебуває на межі оптогенетики, яка використовує опсини, та хемогенетики, яка використовує як активаторів різні хімічні речовини. Її перевірили на лабораторних мишах, чию поведінку намагалися змінити. Для цього нейрони моторної кори однієї півкулі мозку мишей змусили посилено експресувати білок TRPV1 введенням відповідного гену, а через 3-4 тижні у ту ж ділянку ввели розчин наночастинок. Відтак арену з мишами стали піддавали ближньому інфрачервоному випромінюванню вищезгаданого діапазону й спостерігати за поведінкою піддослідних.
Що змінилося у поведінці мишей?
За звичайних умов миші досліджують арену доволі хаотично, утім, поведінка суттєво змінювалася, коли вчені вмикали інфрачервоне випромінювання. Усього через п'ять секунд миші починали рухатися колами, щоразу повертаючи в один бік. Ця зміна була зумовлена успішною однобічною стимуляцією моторної кори. Вона показала, що система з інфрачервоного світла й наночастинок працює, причому, як свідчать досліди, навіть якщо джерело випромінювання розташувати на висоті понад 50 сантиметрів від голови мишей, завдяки чому можна дати тваринам більше свободи для прояву типової поведінки. Після того, як світло вимикали, потребувалося близько 11 секунд, щоб усунути його вплив. Для порівняння, «вимикання» наслідків хемогенетики займає години.
Подальші досліди також показали, що технологія годиться і для стимуляції глибоких мозкових структур. Так, вченим вдалося простимулювати інфрачервоним світлом вентральну область покришки на глибині шість міліметрів під скальпом, залучену до роботи системи винагород та задоволення. Унаслідок цього миші стали суттєво більше часу проводити саме в тій частині лабіринту, яка добре освітлювалася ближнім інфрачервоним випромінюванням.
Отже, вчені показали, що можна керувати активністю нейронів, що розташовуються на глибині, за допомогою ближнього інфрачервоного світла і без опсинів. Та найважливіше, що при цьому не потрібно використовувати громіздкого для тварин обладнання, яке обмежує їхню рухливість і нормальну поведінку, як зазвичай при оптогенетиці. Водночас, описаний підхід дає змогу більш акуратно контролювати процес стимуляції, ніж хемогенетика, яка теж дозволяє обійти обмеження у рухливості тварин. Поки що технологія інвазивна, зважаючи на потребу введення наночастинок та гену терморецептора в мозкові структури, але в майбутньому цей недолік планують обійти за допомогою ультразвуку, що допоможе проникнути речовинам до мозку з крові через гематоенцефалічний бар'єр.
Раніше ми писали про інше дослідження цієї сфери, у якому вченим вдалося пристосувати саме оптогенетику до неінвазивного та віддаленого керування тваринами. Для цього використали потужний опсин, ген якого ввели не в мозок, а в кровотік, та світло, що змогло проникнути на глибину до семи міліметрів.




